UDI - Kennzeichnung von Medizinprodukten
Sie sind Hersteller von Medizinprodukten (MD) und In-vitro-Diagnostika (IVD) und müssen Ihre Produkte UDI-konform kennzeichnen? GS1 Switzerland ist eine offizielle UDI-Zuteilungsstelle.
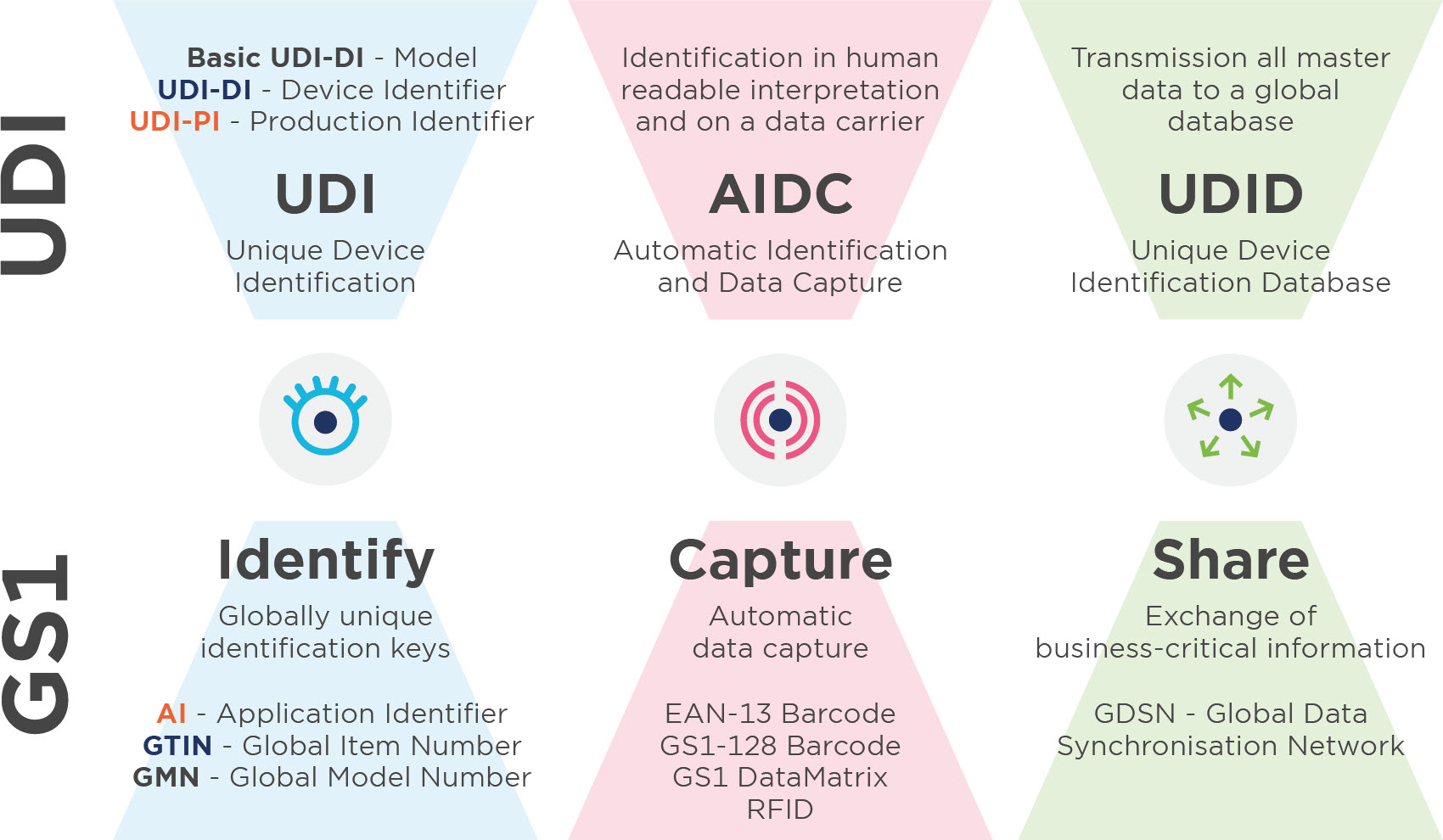
Unique Device Identification (UDI) ist ein System zur Identifikation, Kennzeichnung und Registrierung von Medizinprodukten. Ziel ist es, die Patientensicherheit durch die lückenlose Rückverfolgbarkeit von Produkten zu erhöhen. Derzeit ist UDI gesetzlich verpflichtend für alle Hersteller von Medizinprodukten und In-Vitro-Diagnostika u.a. in Europa und in den USA.
EU UDI
Die Medical Device Regulation (MDR) und die In-Vitro Diagnostic Regulation (IVDR) sind seit dem Jahre 2017 in Kraft. Die Schweiz hat gemäss der rechtlichen Grundlagen der Swissmedic eine EU äquivalente Medizinprodukteregulierung.
Laufende Updates zur MDR und IVDR sind auf der Webseite von Swissmedic aufgeführt, auf der Sie auch eine Übersicht über die in der Schweiz verwendeten, internationalen Standards, sowie die EUDAMED Timeline finden.
Wichtiger Hinweis für die Umsetzung der UDI:
Für Medizinprodukte der drei Klassen I/IIa/IIb/III muss die Liste aller vergebenen UDIs für jedes Medizinprodukt als Teil der technischen Dokumentation gepflegt werden. Die Angabe der Basis UDI-DI (GS1= Global Model Number) auf der EU-Konformitätserklärung und den technischen, klinischen sowie Sicherheitsdokumentationen und Zertifikate für die Registrierung und Bescheinigungen zwingend erforderlich. Es bestehen teilweise noch Übergangsfristen.
Wir von GS1Switzerland begleiten Sie bei der Umsetzung von UDI und bieten auch Lösungen an die UDI Daten auf die regulatorischen Datenbanken wie GUDID, EUDAMED, swissdamed und weitere ermöglichen.
Alles, was Sie zur Basis UDI-DI wissen müssen
In 5 Schritten zur UDI
Wo stehe ich in der UDI Umsetzung?
Bevor Sie mit Ihrer Arbeit hinsichtlich UDI starten, sollten Sie sich zu folgenden 5 Fragen Gedanken machen. Sie werden erkennen, dass UDI kein Einzelwettkampf, sondern eine Gruppendisziplin ist, welche Ihre gesamte Wertschöpfungskette betrifft.
- Welche Produkte sind von der MDR / IVDR betroffen?
- In welchen Klassen sind diese Produkte eingeteilt?
- Gibt es Änderungen in den Klassen?
- Wie viele Produkte sind davon betroffen?
- Nutzen Sie bereits das GS1 System?
- Ist ein GCP (Global Company Prefix) vorhanden?
- Wie ist die GTIN-Vergabe geregelt? (GCP wird benötigt für GMN in
EUDAMED / GUDID und/oder GTIN)
- Ist breites UDI-Wissen im Unternehmen vorhanden?
- Sind die regulatorischen Anpassungen bekannt?
- Sind Fristen bekannt?
- Wie ist UDI in Ihrer Unternehmung organisatorisch eingebettet?
- Betrachten Sie UDI als Projekt oder ist es bei einer Person angelagert?
1. Mitgliedschaft abschliessen
Um die GS1 Standards zu nutzen, benötigen Sie eine Mitgliedschaft mit Benutzung GS1 System (Barcodes).
2. Zuteilung Basis-UDI (nur in Europa)
Die Basis UDI-DI ist das wichtigste Ordnungsmerkmal für Datensätze in der UDI-Datenbank (MDR und IVDR) und dient der Identifikation von Produktmodellen oder Produktfamilien. Diese erscheint in allen Dokumenten (v. a. Konformitätserklärung und technische Dokumentation).
Mehr dazu lesen Sie u. a. im MedTech Europe Dokument „Guidance on Basic UDI-DI Assignment“ oder in den UDI Guidance Dokumenten der MDCG.
Zur Erstellung der Basis UDI-DI verwenden Sie die Global Model Number (GMN). Die Basis UDI_DI wird nie auf dem Produkt angebracht.
3. Zuteilung der UDIs
3.1. Allgemeine Anforderungen
Der Hersteller teilt eindeutige UDIs für seine Produkte zu und pflegt diese. Die UDI darf nur vom Hersteller auf dem Produkt oder seiner Verpackung angebracht werden. Jede einzelne Komponente oder jedes kommerzielles Handelsprodukt verfügt über eine eigene gesonderte UDI. Es sei denn, die Komponenten sind Teil eines konfigurierbaren Produkts, welches mit einer eigenen UDI gekennzeichnet ist. Versandcontainer oder Transporteinheiten sind von der UDI-Zuteilung nicht betroffen, werden aber z.B. für die Sendungsrückverfolgbarkeit mit dem Serial Shipping Container Code (SSCC) ausgezeichnet. GTIN-Registry und MyGTIN hilft Ihnen bei der Organisation Ihrer GTINs.
3.2. Die Gebrauchseinheit-DI
Die Gebrauchseinheit-DI dient dazu, die Anwendung eines Produkts einem Patienten in den Fällen zuzuordnen, in denen die UDI nicht auf dem einzelnen Produkt auf Ebene seiner Gebrauchseinheit angegeben ist, z. B. wenn mehrere Einheiten desselben Produkts zusammen verpackt sind. Zur Identifikation Ihrer Gebrauchseinheiten verwenden Sie die GTIN – Global Trade Item Number.
3.3. UDI-DI (GS1:GTIN)
Sie teilen allen Artikeln in Ihrem Sortiment eine GTIN (= UDI-DI) zu. Nicht nur Gebrauchseinheiten, sondern auch höhere Verpackungseinheiten sollten eine GTIN (Global Trade Item Number) erhalten. Die UDI-DI ist auf allen Ebenen der Produktverpackung einmalig.
Ausgenommen sind Versandeinheiten, Sonderanfertigungen und Prüfprodukte.
Die UDI-DI ist ein einmaliger numerischer Code, der einem Produktmodell eigen ist und der auch als „Zugangsschlüssel“ zu Informationen in einer UDI-Datenbank dient.
Bitte beachten Sie bei der Zuteilung aller Identifikationsnummern die jeweiligen Vergabe- und Änderungsregeln (siehe MDR/IVDR Anhang VI, Teil C, Absatz 3 und 6). Einerseits sind diese in MDR und IVDR verankert und andererseits gibt es die GTIN Vergaberegeln im Gesundheitswesen.
3.4. UDI-PI (GS1: AI)
Die UDI-PI ist ein numerischer oder alphanumerischer Code, mit dem die Produktionseinheit des Produkts gekennzeichnet wird. Zu den wichtigsten UDI-PIs zählen die Chargen-, Serien-, Losnummer, das Verfalls- oder Herstellungsdatum und die Softwareidentifikation.
Wird auf der Kennzeichnung eine Losnummer, eine Seriennummer, eine Software-Identifikation oder ein Verfallsdatum angegeben, so ist diese bzw. dieser Teil der UDI-PI. Befindet sich auf der Kennzeichnung auch das Herstellungsdatum, so muss dieses nicht in die UDI-PI aufgenommen werden. Befindet sich auf der Kennzeichnung nur das Herstellungsdatum, so ist dieses als UDI-PI zu verwenden. GS1 bietet zur Zuordnung der UDI-PIs die GS1 Application Identifier (AI) an. Die Formate der AIs sind bei der Erstellung von UDI-PIs in jedem Fall einzuhalten.
3.5 Master UDI-DI (MUDI)
Bei Kontaktlinsen, Brillengläser und Fertiglesegeräten besteht eine neue Verordnung (EU) 2017/745 hinsichtlich der Zuteilung einmaliger Produktkennungen. Stark individualisierte Produkte mit eindeutigen klinischen Ähnlichkeiten können mit einer „Master UDI“ (MUDI) zusammengefasst werden. Bei Fragen zur Master UDI-DI nehmen sie bitte Kontakt mit uns auf.
4. Auswahl des UDI-Trägers
Grundsätzlich sind primär die in MDR/IVDR gelisteten Anforderungen an UDI-Träger zu berücksichtigen. Diese sind die in MDR/IVDR Anhang VI Teil C Absatz 4 zu finden.
Folgende GS1 Strichcodes sind als UDI-Träger zulässig:
-GS1-128
-GS1 DataMatrix
Zum 1D- oder 2D-Strichcode können Sie auch die RFID-Technologie verwenden. GS1 unterstützt zwei Frequenzbereiche – den Ultrahochfrequenzbereich (UHF) zwischen 860 und 960 MHz, sowie den Hochfrequenzbereich (HF) mit 13,56 MHz.
Sie wollen sichergehen, dass der erstellte Strichcode gescannt werden kann? Dann lassen Sie ihn vom GS1 Switzerland Strichcodeservice kontrollieren. Wir checken die Druckqualität, die Datenstruktur, den Aufbau und die Abmessungen.
5. Upload der UDI Daten (Registrierung) in Europa und den USA
5a. Registrierung in regulatorischen Datenbanken SWISSDAMED (CH) und EUDAMED (EU)
Die Basis UDI-DI und alle erstellten UDI-DIs samt den zugehörigen Produktdaten benötigen Sie vor dem In-Verkehr-Bringen zur Registrierung Ihrer Produkte in den Datenbanken für Medizinprodukte SWISSDAMED und EUDAMED.
Danach halten Sie diese Informationen stets auf dem neuesten Stand. Die UDI-Produktregistrierung können sie unter Berücksichtigung der EUDAMED Funktionsfähigkeit vorbereiten und eingeben.
Vergessen Sie nicht, dass alle Prozesse zur Registrierung und zur Aktualisierung der UDI-Daten im QMS dokumentiert werden müssen.
Siehe auch MDCG 2021-19.
Jede Basis-UDI-DI (nur in der EU) und auch jede UDI-DI wird mit einem behördlich festgelegten Datensatz in die UDI-Datenbank eingetragen.
5b. Registrierung in regulatorischen Datenbank GUDID (USA)
Medizinprodukte, die an den US-amerikanischen Markt geliefert werden, müssen anhand der UDI-Richtlinie der US-amerikanischen FDA eindeutig identifiziert und gekennzeichnet werden.
Für die Hersteller bzw. „Labeler“ bedeutet das: Wollen Sie Ihre Produkte weiterhin in den amerikanischen Markt exportieren, müssen Sie die UDI-Auflagen erfüllen.
Weitere Details zu den UDI-Anforderungen der US FDA erhalten Sie über die sehr ausführliche Website der FDA oder über die Website von GS1 US. Bitte beachten Sie, dass Sie als GS1 Nutzer die Anforderungen der FDA erfüllen können. Ein zusätzlicher Vertrag mit GS1 US ist grundsätzlich nicht notwendig.
Die US UDI-Timeline
Eine ausführliche Übersicht gibt es hier: Compliance Dates for UDI Requirements
Übermittlung von UDI-Daten an GUDID (Registrierung)
Alle Informationen über die Global UDI Database (GUDID) finden Sie auf der Website der FDA.
Detailinformationen
Die EU UDI Timeline
Das Medizinprodukterecht des Bundesamt für Gesundheit gibt vor welche Beschlüsse der EU Kommission wann in der Schweiz zur Anwendung kommen. In den letzten Jahren hat die EU die Anforderungen an die Medizinprodukte verschärft, um die Qualität und Sicherheit dieser Produkte zu verbessern. Die EU-Verordnungen über Medizinprodukte (MDR) und über In-vitro-Diagnostika (IVDR) sind am 26. Mai 2017 in Kraft getreten und sind seit dem 26. Mai 2021 bzw. 26. Mai 2022 voll anwendbar.
Die Schweiz hat ihre Gesetzgebung in gleicher Weise angepasst, um sie auf diejenige der EU abzustimmen. Die Bestimmungen der MDR wurden in das HMG, das HFG, die MepV und die neue KlinV-Mep übernommen. Die Verordnungen sind seit dem 26. Mai 2021 in Kraft. Die Bestimmungen der IVDR wurden in das HMG, das HFG, die neue IvDV und die KlinV-Mep überführt, die seit dem 26. Mai 2022 in Kraft sind.
Das Abkommen der Schweizerischen Eidgenossenschaft und der Europäischen Union über die gegenseitige Anerkennung der Konformitätserklärungen-MRA ist wegen fehlender Fortschritte in institutionellen Fragen zwischen der Schweiz und der EU ins Stocken geraten. Die Europäische Kommission hat die Aktualisierung dieses Kapitels bislang abgelehnt. Über die Auswirkungen und den aktuellen Entwicklungsstand informiert das Bundesamt für Gesundheit laufend, auf ihrer BAG-Medizinprodukte-Webpage.
UDI-Träger auf der Kennzeichnung
Das Anbringen eines UDI-Trägers auf der Kennzeichnung Ihrer Produkte und auf allen höheren Verpackungsebenen (ausgenommen sind Versandcontainer) erfolgt je nach der Einstufung des Produkts in Risikoklassen.
MD-Klassen (siehe MDR Art. 123 Abs. 3f)
Klasse I

Klasse II

Klasse III

IVD-Klassen (siehe IVDR Art. 113 Abs. 3e)
IVD Klasse D

IVD Klasse B & C

Klasse A

Die Deadlines der Einführungen (Pfeile) der Risikoklassen werden in den Swissmedic-Regulierungen bekannt gegeben. Beachten sie das für wiederverwendbare Produkte, bei denen der UDI-Träger direkt auf das Produkt aufgebracht werden muss, andere Fristen gelten.
Auswirkungen der Medizinprodukteverordnung (MepV) in der Schweiz
Aufgrund eines fehlenden MRA (Mutual Recognition Agreement) zwischen der Schweiz und der EU ergeben sich für den Schweizer Markt Besonderheiten, die es als Hersteller, Importeur oder Distributor von Medizinprodukten zu beachten gibt.
In der Schweiz gilt die CH-MepV-Medizinprodukteverordnung, welche das Europäische Recht nur teilweise übernimmt.
Das fehlende MRA betrifft sowohl Importe, wie auch Exporte von Medizinprodukten. Wir fokussieren uns bei unserer Kommunikation auf den Import. Für exportierende Unternehmen hat der Branchenverband SWISS MEDTECH detaillierte Informationen publiziert.
Die Kommunikation der EU und auch der Schweiz verweisen immer wieder darauf, dass Gespräche noch im Gange sind und mögliche Entwicklungen kommuniziert würden.
Konformitätskennzeichen und Kennnummer
(MepV Art. 13 Konformitätskennzeichen und Kennnummer)
Produkte, die in der Schweiz in Verkehr gebracht oder auf dem Schweizer Markt bereitgestellt werden, müssen ein Konformitätskennzeichen nach Anhang 5 tragen. Als Konformitätskennzeichen zulässig ist ebenfalls das Konformitätskennzeichen, das in Anhang V EU-MDR18 aufgeführt ist.
Nebst dem in Anhang V EU-MDR beschriebene CE Kennzeichen, ist in Anhang 5 der MepV auch ein nationales Konformitätskennzeichen beschrieben. Beide Kennzeichen sind zulässig.
Produktinformationen
(MepV Art. Art. 16 Produktinformation)
Die Produktinformationen müssen in drei Amtssprachen abgefasst sein. Artikel 16 regelt in welchen Fällen die Produktinformationen in weniger als den drei Amtssprachen oder auf Englisch abgefasst sein dürfen (Absatz 3).
Implantationsausweis
(MepV Art. 20 Informationen zu implantierbaren Produkten)
Der Hersteller ist verpflichtet neben den Produktinformationen gemäss MepV Artikel 16 und Artikel 18 EU-MDR auch einen Implantationsausweis in den drei Landessprachen dem Produkt beizulegen.
Registrierung der Wirtschaftsakteuren
(MepV Art. 55 – Registrierung von Wirtschaftsakteuren)
Hersteller, deren Bevollmächtigte oder Importeuren registrieren sich bei Swissmedic, innerhalb von drei Monaten seit dem ersten Inverkehrbringen eines Produktes.
Antragsformular: Einmalige Identifikationsnummer nach Art- 55 MepV (CHRN Swiss Single Registration Number)
Informationssystem Medizinprodukte
(MepV Art. 2. Abschnitt: Informationssystem Medizinprodukte – Art. 83ff)
Artikel 83 – 92 beschreiben ein Informationssystem für Medizinprodukte. Swissmedic trägt die Verantwortung für dieses Informationssystem und ist zuständig für die Erstellung eines Benutzungsreglements ist.
Daten können dabei sowohl aus der EUDAMED als auch aus kantonalen elektronischen Systemen bezogen werden.
Anbringung des UDI (Symbol auf Produkt oder auf Label)
Die Fristen für die Anbringung der UDI, weichen nicht von der EU-MDR ab. Sie sind in der MepV Art. 104 – Anbringen des UDI auf den fortlaufenden Seiten definiert.
Benennung eines Bevollmächtigten
(MepV Art. 104a Benennung eines Bevollmächtigten)Hat ein Hersteller seinen Sitz nicht in der Schweiz, so dürfen seine Produkte nur in Verkehr gebracht werden, wenn eine Person mit Sitz in der Schweiz bevollmächtigt wurde. Das Mandat ist schriftlich zu vergeben.
Umsetzungsvorschlag der Medizinprodukteverordnung (MepV) in der Schweiz
Wir empfehlen Ihnen drei Vorgehensweisen zur Umsetzung der UDI, damit Sie die Vorgaben der MDR/IVDR erfüllen:
- Selbststudium
Mit unserer übersichtlichen Webseite zeigen wir Ihnen in 5 Schritten die Umsetzung der UDI. Sie finden zudem viele hilfreiche Tutorials und weiterführende Links, welche Ihnen auf dem Weg der Umsetzung nützlich sein werden. Sie benötigen hierfür lediglich eine Mitgliedschaft mit einem Nummernkreis, um Ihre Produkte auszuzeichnen.
- Training und Umsetzung
Sie besuchen eines unserer vielen Schulungsangebote rund um die UDI und bauen sich so das benötigte Wissen auf. Das von uns vermittelte Wissen und die nützlichen Informationen auf unserer Webseite www.gs1.ch/udi werden Ihnen bei der Umsetzung der UDI helfen.
- Zielgerichtete Schulung Ihrer Unternehmung
Sie haben keine Zeit, um einen UDI-Wissensträger aufzubauen und wollen diesen initialen Auftrag uns übertragen? Wir helfen Ihnen mittels digitalen oder auch vor Ort-Schulungen zielgerichtet UDI-Wissen anzueignen. Sie wählen die Themen und den Zeitumfang, wir liefern den Rest. Unser UDI-Team wird Sie bei der Umsetzung begleiten. Nehmen Sie mit uns Kontakt auf und lassen Sie sich Ihr massgeschneidertes Angebot berechnen.
GS1 Healthcare Videos
Wichtige Links