UDI - étiquetage de dispositifs médicaux
Vous êtes fabricant de dispositifs médicaux (DM) et de dispositifs médicaux de diagnostic in vitro (DIV) et vous devez étiqueter vos produits conformément à l'UDI ? GS1 Switzerland est un organisme officiel d'attribution de l'UDI.
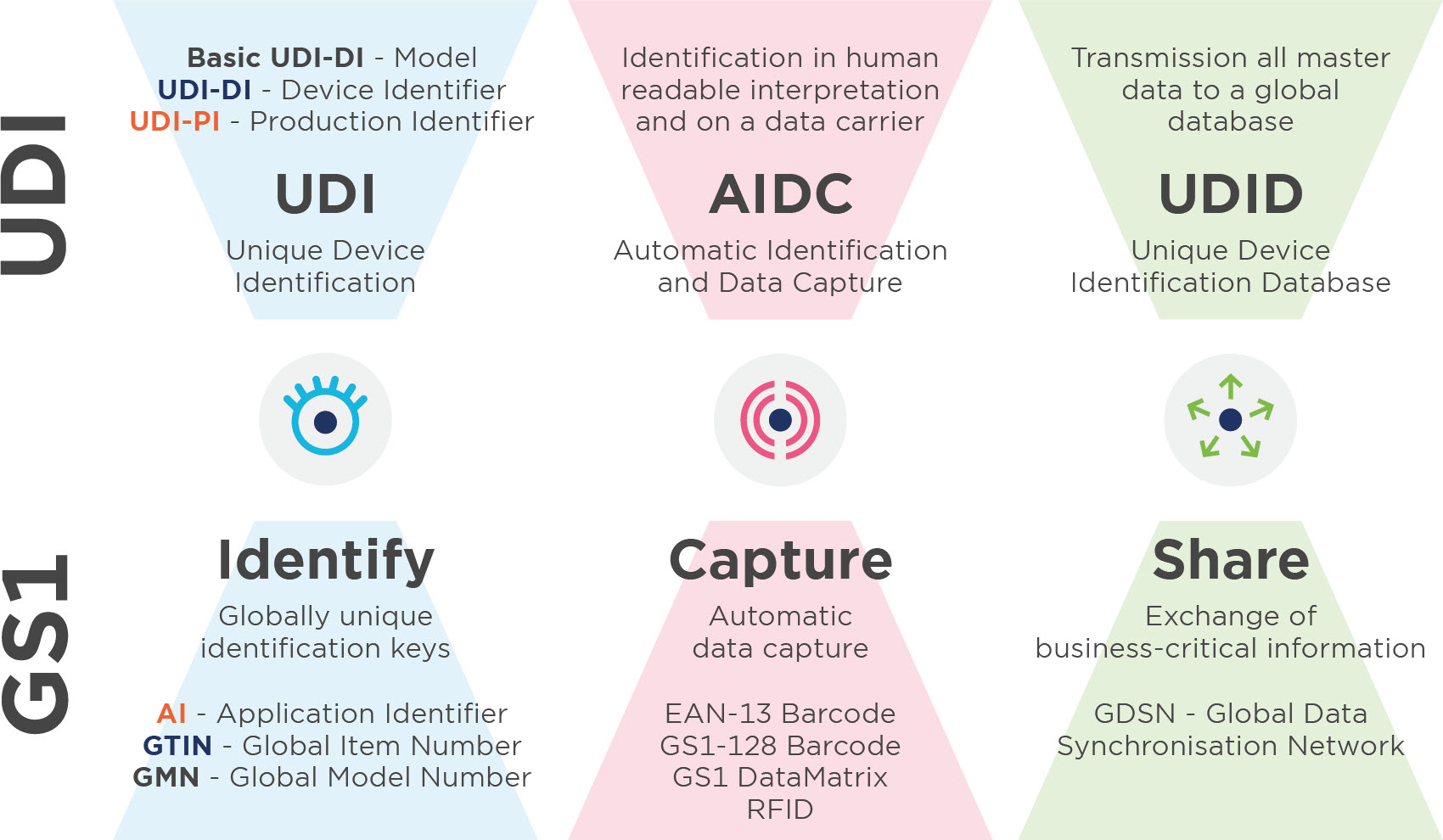
Unique Device Identification (UDI) est un système d'identification, d'étiquetage et d'enregistrement des dispositifs médicaux. L'objectif est d'améliorer la sécurité des patients grâce à une traçabilité complète des produits. Actuellement, l'UDI est légalement obligatoire pour tous les fabricants de dispositifs médicaux et de dispositifs de diagnostic in vitro en Europe et aux Etats-Unis.
EU UDI
Le règlement (UE) 2017/745 relatif aux dispositifs médicaux (RDM) et le règlement (UE) 2017/746 relatif aux dispositifs médicaux de diagnostic in vitro (RDIV) sont en vigueur depuis 2017. Selon les bases légales de Swissmedic, la Suisse a une réglementation des dispositifs médicaux équivalente à celle de l'UE.
Les mises à jour en cours concernant le RDM et le RDIV sont indiquées sur le site web de Swissmedic, sur lequel vous trouverez également un aperçu des normes internationales utilisées en Suisse, ainsi que la chronologie EUDAMED.
Remarque importante pour la mise en œuvre de l'UDI :
Pour les dispositifs médicaux de classe I, il est impératif d'indiquer la base UDI-DI sur la déclaration de conformité UE et la documentation technique.
Chez GS1 Switzerland, nous vous accompagnons dans la mise en œuvre de l'UDI.
Tout ce que vous devez savoir sur la base UDI-DI
En 5 étapes vers l'UDI
Où en suis-je dans la mise en œuvre de l'UDI ?
Avant de commencer votre travail sur l'UDI, vous devriez réfléchir aux 5 questions suivantes. Vous vous rendrez compte que l'UDI n'est pas une compétition individuelle, mais une discipline de groupe qui concerne l'ensemble de votre chaîne de création de valeur.
-
Quels sont les dispositifs concernés par le RDM / RDIV
-
Dans quelles classes ces produits sont-ils répartis ?
- Y a-t-il des changements dans les classes ?
- Combien de produits sont concernés -
Utilisez-vous déjà le système GS1 ?
- Existe-t-il un GCP (Global Company Prefix) ?
- Comment l'attribution du GTIN est-elle réglée ? (Le GCP est nécessaire pour le GMN en
EUDAMED / GUDID et/ou GTIN) -
L'entreprise dispose-t-elle d'une large connaissance de l'UDI ?
- Les adaptations réglementaires sont-elles connues ?
- Les délais sont-ils connus ? -
Comment l'UDI est-elle intégrée dans l'organisation de votre entreprise ?
- Considérez-vous l'UDI comme un projet ou est-elle rattachée à une personne ?
1. Conclure l'adhésion
Pour pouvoir utiliser les standards GS1, vous devez d'abord conclure un contrat pour le système GS1
2. Attribution UDI de base
Le RDM et le RDIV définissent l'UDI-DI de base comme l'identifiant principal d'un modèle de produit, qui est attribué au niveau de l'unité d'utilisation du produit. C'est la caractéristique de classification la plus importante pour les enregistrements de la base de données UDI et elle est indiquée dans les certificats et les déclarations de conformité de l'UE correspondants. Pour attribuer l'indice UDI-DI de base, utilisez le Global Model Number.
3. L'allocation des UDI
3.1. Conditions générales
Le fabricant attribue des UDI uniques à ses produits et les entretient. L’UDI ne peut être appliquée sur le produit ou son emballage que par le fabricant. Chaque composant individuel ou produit commercial dispose de sa propre UDI distincte. Sauf si les composants font partie d'un produit configurable, qui est identifié par une UDI propre. Les conteneurs d'expédition ou les unités de transport ne sont pas concernés par l'attribution de l'UDI, mais sont marqués par le Serial Shipping Container Code (SSCC), par exemple pour la traçabilité des envois. GTIN Registry et MyGTIN vous aident à organiser vos GTIN.
3.2. L'unité d'utilisation DI
L'unité d'utilisation DI est utilisée pour attribuer l'utilisation d'un produit à un patient dans les cas où la DI n'est pas indiquée sur le produit individuel au niveau de son unité d'utilisation, par exemple lorsque plusieurs unités du même produit sont conditionnées ensemble. Vous utilisez le GTIN - Global Trade Item Number pour identifier vos unités d'utilisation.
3.3. UDI-DI
L'UDI-DI est un code numérique ou alphanumérique unique inhérent à un modèle de produit et sert également de "clé d'accès" aux informations contenues dans une base de données UDI. L'UDI-DI est unique à tous les niveaux de l'emballage des produits. Vous utilisez un GTIN - Global Trade Item Number pour identifier vos produits et les niveaux d'emballage disponibles. (Lien vers l'image avec les escaliers : Identification des niveaux de produits et d'emballages) Lors de l'attribution de tous les numéros d'identification, veuillez respecter les règles d'attribution et de modification respectives (voir annexe VI, partie C, paragraphes 3 et 6, du RIM/IVDR). D'une part, ces règles sont ancrées dans le MDR et l'IVDR et d'autre part, il y a les règles d'attribution du GTIN dans les soins de santé.
3.4. UDI-PIL'UDI-PI est un code numérique ou alphanumérique identifiant l'unité de production du produit. Les différents types d'identifications UDI-PI comprennent le numéro de série, le numéro de lot, l'identification du logiciel et la date de fabrication ou d'expiration, ou les deux. Si un numéro de lot, un numéro de série, une identification de logiciel ou une date d'expiration est indiqué sur l'étiquette, il fait partie de l'UDI-PI. Si la date de fabrication figure également sur l'étiquette, il n'est pas nécessaire de l'indiquer dans l'identification numérique universelle. Si seule la date de fabrication figure sur l'étiquette, celle-ci doit être utilisée comme UDI-PI. Pour ce faire, vous pouvez utiliser le GS1 Application Identifier (AI).
4. La sélection du transporteur UDI approprié
Fondamentalement, les exigences pour les transporteurs UDI figurant dans le RIM/IVDR doivent être considérées en premier lieu. Il s'agit de ceux énumérés à l'annexe VI, partie C, paragraphe 4, du RDM/RDIV.
Les codes à barres GS1 suivants sont autorisés en tant que supports d'UDI :
-GS1-128
-GS1 DataMatrix
-EAN-13 Barcode (jusqu' à 2026)
Vous pouvez également utiliser la technologie RFID pour les codes à barres 1D ou 2D. Le GS1 prend en charge deux gammes de fréquences : la gamme des ultra-haute fréquences (UHF) entre 860 et 960 MHz, et la gamme des hautes fréquences (HF) à 13,56 MHz.
5. Le téléchargement de données UDI vers EUDAMED
Vous aurez besoin de l'UDI-DI de base et de toutes les UDI-DI créées ainsi que des données de produit correspondantes pour l'enregistrement de vos produits dans la base de données européenne pour les dispositifs médicaux (EUDAMED - voir également l'annexe VI, partie A, du RDM/RDIV) avant de les mettre sur le marché. Par la suite, vous devez toujours tenir ces informations à jour.
Vous aurez besoin de l'UDI-DI de base et de toutes les UDI-DI créées ainsi que des données de produit correspondantes pour l'enregistrement de vos produits dans la base de données européenne pour les dispositifs médicaux (EUDAMED - voir également l'annexe VI, partie A, du RDM/RDIV) avant de les mettre sur le marché. Par la suite, vous devez toujours tenir ces informations à jour. Jusqu’à présent, la Commission Européenne n'a pas encore publié d'avis au Journal officiel de l'Union Européenne indiquant qu'EUDAMED est pleinement opérationnel et aucun enregistrement ne peut donc être effectué à ce stade. Cependant, vous pouvez déjà préparer l'échange de données selon les directives de l'UDI.
GS1 Healthcare Videos
Liens importants
EU UDI Timeline
La législation sur les dispositifs médicaux de l'Office fédéral de la sant'e publique indique quelles décisions de la Commission européenne doivent être appliquées en Suisse et quand. Ces dernières années, l'UE a renforcé les exigences relatives aux dispositifs médicaux afin d'améliorer la qualité et la sécurité de ces produits. Les règlements de l'UE sur les dispositifs médicaux (RDM) et sur les dispositifs médicaux de diagnostic in vitro (IVDR) sont entrés en vigueur le 26 mai 2017 et sont pleinement applicables depuis le 26 mai 2021 et le 26 mai 2022 respectivement.
La Suisse a adapté sa législation de la même manière afin de l'aligner sur celle de l'UE. Les dispositions de la RDM ont été reprises dans la LPTh, la LRH, l'ODim et la nouvelle OClin-Mep. Les règlements sont en vigueur depuis le 26 mai 2021. Les dispositions de la DIVR ont été transférées dans la LPTh, la LRH, la nouvelle OICM et l'OClin-Mep, qui sont en vigueur depuis le 26 mai 2022.
L'accord entre la Confédération suisse et l'Union européenne sur la reconnaissance mutuelle des déclarations de conformité-ARM est au point mort en raison de l'absence de progrès sur les questions institutionnelles entre la Suisse et l'UE. La Commission européenne a jusqu'à présent refusé la mise à jour de ce chapitre. L'Office fédéral de la santé publique informe en permanence sur les conséquences et l'état actuel du développement, sur sa page web sur les dispositifs médicaux de l'OFSP.
Support UDI sur l'étiquetage
L'apposition d'un support UDI sur l'étiquetage de vos produits et sur tous les niveaux supérieurs d'emballage (à l'exception des conteneurs d'expédition) se fait en fonction de la classification du produit en classes de risque.
Classe-MD (siehe voir RDM Art. 123 Abs. 3f)
Classe I

Classe II

Classe III

Classe-DIV (voir RDIV Art. 113 Abs. 3e)
Classe DIV D

Classe DIV B & C

Classe A

Les délais d'introduction (flèches) des classes de risque sont communiqués dans les réglementations de Swissmedic. Veuillez noter que d'autres délais s'appliquent aux produits réutilisables pour lesquels le support UDI doit être appliqué directement sur le produit.
Effets de l'Ordonnance sur les dispositifs médicaux (ODim) en Suisse
En raison de l'absence d'un ARM (accord de reconnaissance mutuelle) entre la Suisse et l'UE, le marché suisse présente des particularités dont les fabricants, importateurs ou distributeurs de dispositifs médicaux doivent tenir compte.
En Suisse, la version ODim du 1er juillet 2020 (dès le 26 mai 2021), qui ne reprend que partiellement le droit européen, est en vigueur depuis le 26 mai 2021.
L'ARM manquant affecte à la fois les importations et les exportations de dispositifs médicaux. Nous axons notre communication sur les importations. Pour les entreprises exportatrices, l'association industrielle SWISS MEDTECH a publié des informations détaillées.
La communication de l'UE et de la Suisse fait référence à plusieurs reprises au fait que les discussions sont toujours en cours et que les développements éventuels seront communiqués. Nous vous informerons de l'évolution de la situation dès que possible.
Marquage de conformité et numéro d’identification
(ODim Art. 13 Marquage de conformité et numéro d’identification)
Les dispositifs mis sur le marché en Suisse ou mis à disposition sur le marché suisse doivent porter un marquage de conformité conformément à l’annexe 5. Un marquage de conformité au sens de l’annexe V RDM-UE18 est également admis.
En plus de la marque CE décrite dans l'annexe V du MDR de l'UE, une marque de conformité nationale est également décrite dans l'annexe 5 du ODim. Les deux marques sont autorisées.
Information relative au dispositif
(ODim Art.16 Information relative au dispositif
L’information relative au dispositif doit être rédigée dans les trois langues officielles. L'article 16 réglemente les cas dans lesquels l'information sur le produit peut être rédigée dans une des trois langues officielles ou en anglais (paragraphe 3).
Carte d’implant
(ODim Art. 20 Informations sur les dispositifs implantables
En plus des informations relative au dispositif à l'article 16 du ODim et à l'article 18 du MDR de l'UE, le fabricant est également tenu de joindre au produit une carte d’implant dans les trois langues officielles.
Enregistrement des opérateurs économiques
(ODim Art. 55 Enregistrement des opérateurs économiques
Les fabricants ou leurs mandataires et les importateurs enregistrent auprès de Swissmedic, dans les trois mois suivant la première mise sur le marché d’un dispositif, les données requises dans l’annexe VI, partie A, section 1, RDM-UE6
Formulaire de demande : Numéro d'identification unique selon l'art. 55 MepV (CHRN Swiss Single Registration Number)
Système d’information
(ODim Section 2 : Système d’information sur les dispositifs médicaux
Les articles 83 à 92 décrivent un système d'information pour les dispositifs médicaux. Swissmedic est responsable de ce système d'information et de l'élaboration d'un règlement sur son utilisation.
Les données peuvent être obtenues tant auprès d'EUDAMED que des systèmes électroniques cantonaux.
Système d’information
(ODim Section 2 : Système d’information sur les dispositifs médicaux
Les articles 83 à 92 décrivent un système d'information pour les dispositifs médicaux. Swissmedic est responsable de ce système d'information et de l'élaboration d'un règlement sur son utilisation.
Les données peuvent être obtenues tant auprès d'EUDAMED que des systèmes électroniques cantonaux.
Apposition de l’IUD
Les délais pour l'apposition de l'IUD ne s'écartent pas du MDR de l'UE et sont réglementés comme suit (ODim Art. 104 - Apposition de l'IUD) :
- pour les dispositifs implantables et les dispositifs de classe III, à partir du 26 mai 2021;
- pour les dispositifs de classe IIa et IIb, à partir du 26 mai 2023;
- pour les dispositifs de classe I, à partir du 26 mai 2025;
- pour les dispositifs réutilisables pour lesquels l’IUD doit être apposé sur le dispositif lui-même, dans un délai de 2 ans après les dates fixées aux let. a à c pour la classe de dispositifs concernée.
Désignation d’un mandataire
(ODim Art. 104a Désignation d’un mandataire)
Si le fabricant a son siège dans un État de l’UE ou de l’EEE ou s’il a mandaté une personne ayant son siège dans un État de l’UE ou de l’EEE, il est tenu, pour tous les dispositifs mis sur le marché après le 26 mai 2021, de désigner un mandataire conformément à l’art. 51, al. 1, dans les délais suivants:
- pour les dispositifs de classe III, les dispositifs implantables de classe IIb et les dispositifs médicaux implantables actifs: jusqu’au 31 décembre 2021;
- pour les dispositifs de classe IIb non implantables et les dispositifs de classe IIa: jusqu’au 31 mars 2022;
- pour les dispositifs de classe I: jusqu’au 31 juillet 2022.
Concernant les systèmes et les nécessaires, le mandataire visé à lֹ’art. 51, al. 5, doit être désigné d’ici au 31 juillet 2022.
Proposition de mise en œuvre pour les directives MDR/IVDR & UDI
Nous vous recommandons trois procédures de mise en œuvre de l'UDI afin de satisfaire aux exigences du MDR/IVDR:
1.Auto-apprentissage
Grâce à notre site web clair, nous vous montrons en 5 étapes comment mettre en œuvre l'UDI. Vous y trouverez également de nombreux tutoriels utiles et des liens complémentaires qui vous seront utiles sur le chemin de la mise en œuvre. Pour ce faire, il vous suffit d'être membre et de disposer d'une série de numéros pour étiqueter vos produits.
2.Formation et mise en œuvre
Vous suivez l'une de nos nombreuses offres de formation autour de l'UDI et acquérez ainsi les connaissances nécessaires. Les connaissances que nous vous transmettons et les informations utiles que vous trouverez sur notre site www.gs1.ch/udi vous aideront à mettre en œuvre l'UDI.
3.Une formation ciblée pour votre entreprise
Vous n'avez pas le temps de mettre en place un détenteur de connaissances UDI et souhaitez nous confier cette mission initiale ? Nous vous aidons à acquérir des connaissances UDI de manière ciblée par le biais de formations numériques ou sur place. Vous choisissez les thèmes et la durée, nous nous chargeons du reste. Notre équipe UDI vous accompagnera dans la mise en œuvre. Contactez-nous et demandez une offre sur mesure.